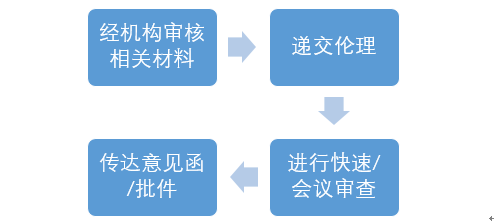
临床试验伦理委员会
回到主站
科室设置
- 党委办公室(保密办公室) 党委组织部 党委宣传统战部(精神文明办公室) 纪委办公室 行风建设办公室 审计办公室 工会 团委(社工办) 组织科 干部科 宣传科 统战科
- 院长办公室(应急办公室) 国际合作与交流办公室/港澳台事务办公室 人力资源部(党委教师工作办公室/人才工作办公室) 运营管理与评价部 学科建设部 财务部 资产管理部 信息管理部 采购部 档案室 法务部 公共事业发展部 法律事务科 人力资源科 劳资社保科 退休办公室 运营评价科 绩效管理科 会计核算科 资金结算科 财务管理科 数据管理科 系统运维科 采购质量管理科 采购科 医联体管理办公室 对外合作办公室
- 医务部 护理部 医院感染管理部 门诊部(互联网医院办公室) 医疗保健部 随访中心 病案管理部 妇儿保健部 医保部 公共卫生办公室 医务科(预防保健科) 医患沟通办公室 医疗质量管理科 护理质量管理科 护理科教科 医院感染控制科 门诊部办公室 职工保健科 患者服务中心 门诊治疗部 省托育指导中心管理办公室
- 教务部
- 科技部 计划成果科 科研基地管理科 科技合作与技术转移科
- 医学装备保障部 后勤管理部 基建办公室 安全保卫部 咨询评估科 医学工程科 设备物资科 物业管理科 膳食中心 运行保障科 项目管理科 治安科 消防科
- 妇产科教研室/妇产科 妇科 卵巢癌中心 妇科肿瘤科 普通妇科 产科 生殖医学中心 生殖医学科 生殖内分泌科 生殖男科/四川省人类精子库 生殖医学研究所 儿科/儿科教研室 新生儿科 儿童心血管科 成人重症医学科 医学遗传研究所 儿童呼吸科 儿童免疫科 儿童血液科 儿童肾脏科 儿童神经科 儿童消化科 儿童感染科 儿童代谢内分泌科 综合儿科 儿童保健科 儿童重症医学科 儿童重症医学科 儿外科 儿童心脏外科 儿童泌尿外科 儿童神经外科 儿童胸外科 儿童骨科 儿童脊柱矫形中心 儿童普外科 综合外科 综合内科 整形美容修复重建科/创面修复中心 甲状腺中心 乳腺中心 康复医学科 中医科 心理健康中心 眼科 耳鼻咽喉头颈外科 口腔科 皮肤科 疼痛科 日间手术部 麻醉手术中心 麻醉科 手术室 医学检验科 产前诊断中心 医学遗传科 输血科 急诊医学科 病理科 药学部 消毒供应中心 华西妇儿营养中心 华西妇儿营养实验室 中试中心 临床营养科 肿瘤中心 放疗科 化疗科 盆底医学中心 医学影像中心 放射科 超声科 妇儿影像研究所 医学遗传中心 危重与急救医学中心 过敏性疾病中心
- 编辑部 西部妇幼医学研究院 筑浪学院 管理培训中心 业务培训部/医学模拟中心 健康教育部 中国出生缺陷监测中心 医院临床试验机构 (医院临床研究中心) IIT中心 生物样本库 临床研究大数据平台 (临床数智研究所) 研究设计与数据分析平台
- 国家卫生健康委员会时间生物学重点实验室(四川大学) 全国妇幼卫生监测办公室/中国出生缺陷监测中心 四川省女性盆底功能障碍性疾病质量控制中心 四川省妇产科质量控制中心 四川省儿科质量控制中心 四川省妇幼临床检验质量控制中心 四川省人类生育力保存质量管理中心 华西儿童医学中心 临床试验伦理委员会 四川华西妇幼健康科技有限公司